Cytométrie en Flux

Cytométrie en Flux
Cytométrie en Flux
CMF Cytek Aurora
Cytomètre analyseur spectral
5 lasers (355, 405, 488, 561, 640nm)
64 paramètres de fluorescence
CMF BD LSR II
Cytomètre analyseur multiparamétrique
4 lasers (355, 405, 488, 633nm)
15 paramètres de fluorescence
Logiciels :
SpectroFlow V3.0 (Cytek)
FACSDiVa V9.0.1 (BD Biosciences)
FlowLogic V8.1 (Miltenyi Biotec)
OMIQ (OMIQ Software)
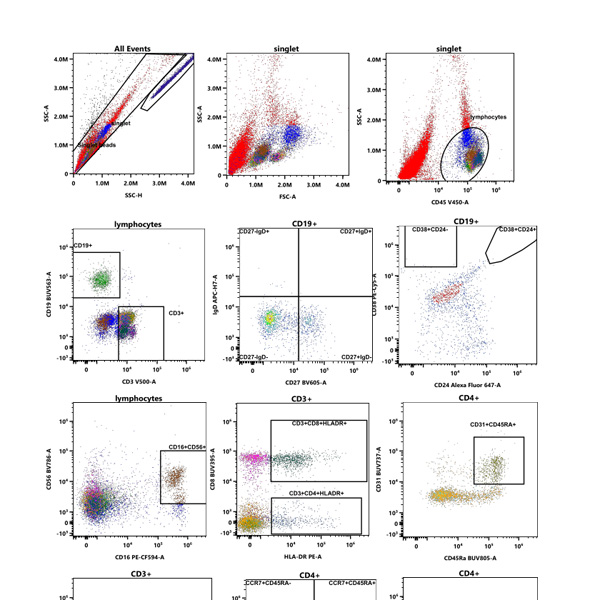
Immunophénotypage
L’immunophénotypage par cytométrie en flux est une technique d’analyse cellulaire à haut débit, permettant d’étudier des antigènes présents à la surface ou dans le cytoplasme de cellules en suspension.
Cette technologie, utilisée principalement pour caractériser les leucocytes, a de nombreuses applications en biologie médicale : en immunologie (étude des lymphocytes sanguins, allergologie), en hématologie maligne (diagnostic et suivi des leucémies, lymphomes) et non maligne. D’autres applications se développent également en bactériologie, pharmacologie, etc
UNH, Ecrein, Evrard B
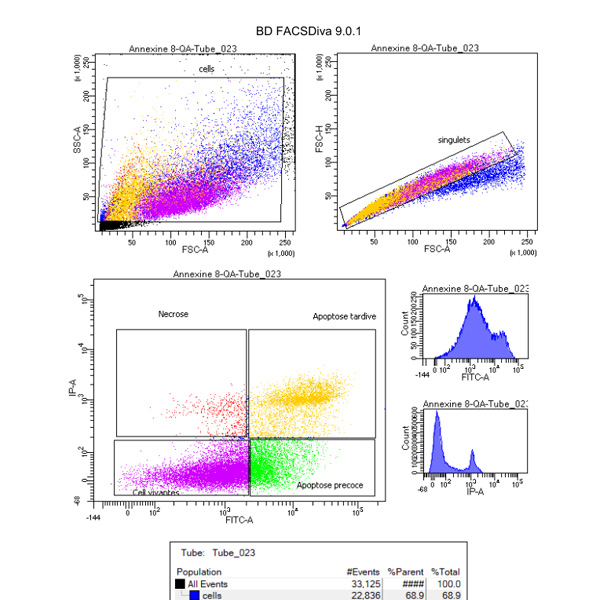
Viabilité cellulaire
Les cellules viables présentent une membrane plasmique formée d’une bi-couche lipidique comprenant sur la face interne des phosphatidyl-sérines. Lors de l’entrée des cellules dans un processus de mort programmée ou apoptose, les phosphatidyl-sérine sont transloqués sur le versant extracellulaire. L’annexine V est une protéine qui possède une forte affinité pour ces phosphatidyl-sérines, et couplée à des fluorophores comme le FITC, elle permet donc de détecter les cellules en phase d’apoptose précoce par cytométrie en flux.
Neurodol, Cia D
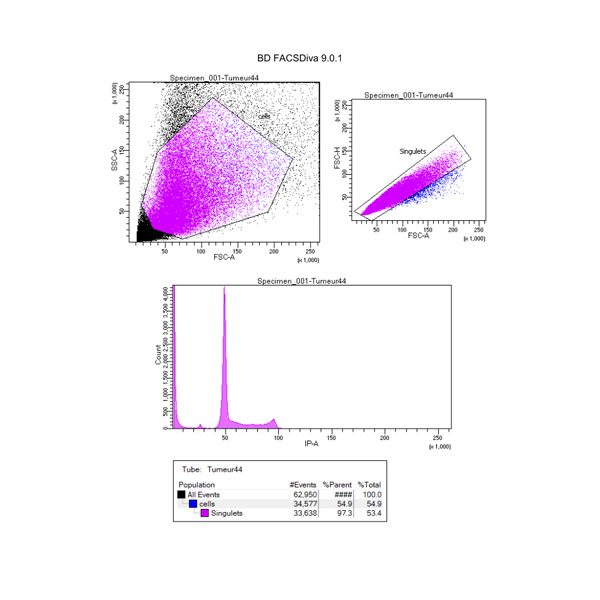
Cycle cellulaire
Marquage réalisé, généralement, avec de l’iodure de propidium permettant de mesurer la quantité d’ADN et de différencier les différentes phases du cycle cellulaire (G0/G1, S, G2/M).
IMoST, Besse S

Salle de culture cellulaire
Une salle de culture cellulaire est à votre disposition pour la préparation de vos cellules : incubateur 37°C-5% CO2, PSM, centrifugeuse, microscope inversé.
