Microscopie Electronique en Transition (MET)
Hitachi H7650 (2006) - 120KV
Source d’électrons = filament LaB6
Haute tension maximale = 120kV
Résolution théorique = 0,2nm
Grandissement x200 à x600000
Porte objet simple tilt +/- 30°
Caméra CCD Hamamatsu AMT40 (1024×1280) position latérale

Hitachi H7650 (2006) - 120KV

Observations et mesures de nanoparticules
Le microscope en transmission du CICS permet d’imager et de mesurer vos nanoparticules après simple dépôt sur une grille de cuivre recouverte d’une membrane de formvar et d’une couche de carbone.
Photo = nanoparticules d’or (IMoST_M. Quintana)
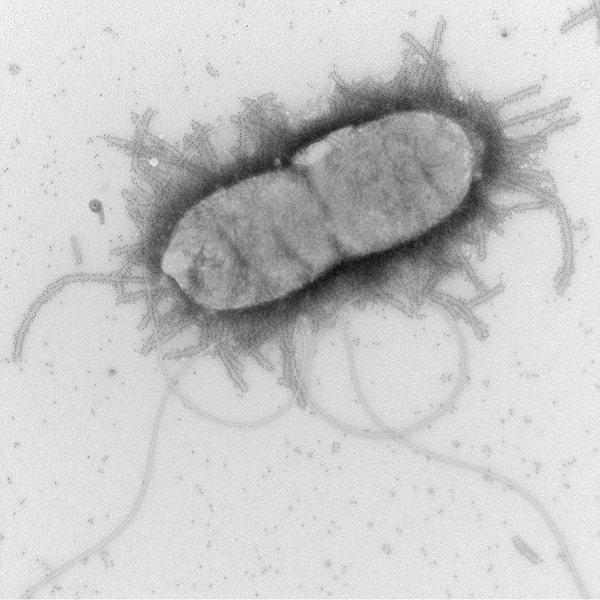
Colorations négatives (bactéries, virus, exosomes…)
La suspension est fixée chimiquement (paraformaldéhyde, glutaraldéhyde) puis déposée sur une grille de cuivre formvar carbone et contrastée avec de l’acétate d’uranyl ou de l’Uranyless ®.
Il est également possible de réaliser un immunomarquage, l’anticorps secondaire étant couplé à une bille d’or opaque aux électrons.
Photo = Marquage des pili d’E.coli LF82 (LMGE_C.Forestier)
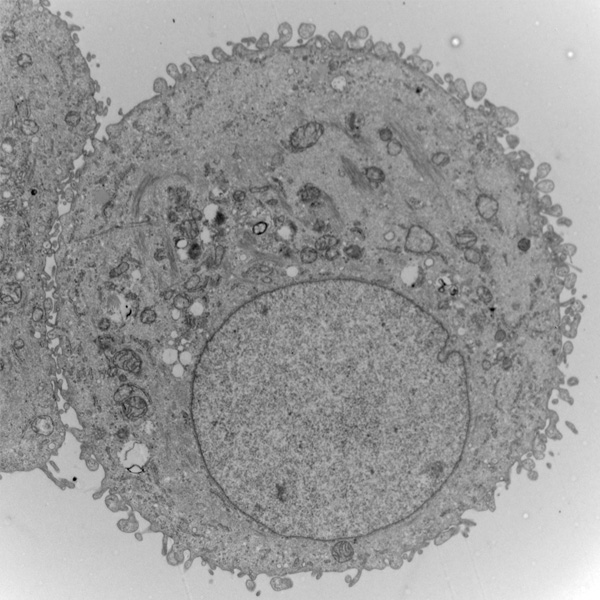
Préparation pour l’observation de l’ultrastructure
(tissus, cellules, micro-organismes…)
Les échantillons sont fixés chimiquement ou physiquement puis déshydratés pour être imprégnés et inclus dans une résine (epoxy).
Des coupes de 70 nm d’épaisseur sont ensuite réalisées à l’ultramicrotome. Déposées sur des grilles elles sont contrastés par des sels de métaux lourds pour pouvoir être observées au MET.
Photo = Cellules épithéliales alvéolaires (Hôpital Henri Mondor _A. De Becdelièvre)

Préparation pour la détection d’antigènes
(tissus, cellules, micro-organismes…)
Le marquage de protéines est possible en ME grâce au couplage des anticorps secondaires avec des billes d’or (entre 5 et 15nm) opaques aux électrons.
Cependant dans la plupart des cas, les techniques classiques de préparation altèrent la conformation de ces protéines, empêchant le couplage avec l’anticorps primaire. Il existe un grand nombre de techniques alternatives permettant d’optimiser le marquage. Au CICS nous pouvons réaliser les techniques de pré-embedding et de post-embedding (Tokuyasu, PLT, HPF-FS). Pour plus de renseignements n’hésitez pas à nous contacter.
Photo = Technique de Tokuyasu _ marquage de la myosine sur muscle de rat (Equipe QuaPA INRAe_T. Astruc)

Equipements de préparation pour la ME
- AMW (Automate Micro Wave) Leica (2012)
Déshydratation et imprégnation sous micro-ondes pour faciliter la pénétration des produits dans des échantillons délicats (tissus nerveux, gras, végétaux…) - Ultramicrotome UC6 Leica (2006)
Coupes semi et ultra-fines (70nm) des échantillons inclus en résine - Cryo-ultramicrotome UC7-FC7 Leica (2015)
Coupes ultrafines (70nm) à froid (azote liquide) d’échantillons fixés et enrobés en sucrose (Tokuyasu) - Cryo fixateur haute pression EM ICE Leica (2020)
Fixation physique des échantillons pour s’affranchir des artéfacts liés aux produits chimiques tout en évitant la formation de cristaux de glace - AFS (Automate Freeze Substitution) Leica (2012)
Freeze substitution après une cryofixation ou technique de PLT (Progressive Lowering of Temperature) sur échantillons fixés chimiquement
Photo = EM ICE Leica (2020)
